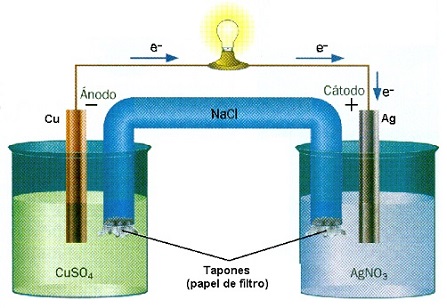
El concepto de reacción redox, tal como se advierte al repasar la teoría, se utiliza para identificar a las reacciones químicas de reducción y oxidación donde intervienen un elemento que cede electrones y otro que los acepta, generándose así transformaciones en los estados de oxidación.
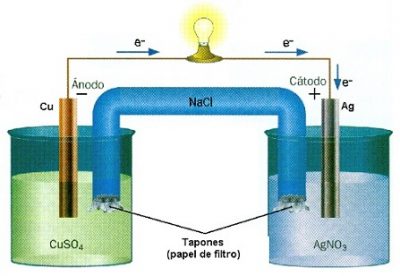 Cuando los reactivos son compuestos orgánicos, por señalar un caso posible, se producen reacciones redox orgánicas. De acuerdo a quienes se especializan en Química Orgánica, en este marco las reducciones y oxidaciones son distintas respecto a las reacciones redox normales ya que no hay, en el sentido electroquímico del término, transferencia de electrones.
Cuando los reactivos son compuestos orgánicos, por señalar un caso posible, se producen reacciones redox orgánicas. De acuerdo a quienes se especializan en Química Orgánica, en este marco las reducciones y oxidaciones son distintas respecto a las reacciones redox normales ya que no hay, en el sentido electroquímico del término, transferencia de electrones.
Cabe destacar además que en los procesos metabólicos una de las reacciones redox fundamentales son las deshidrogenaciones, aunque en las actividades metabólicas hay un gran número de reacciones redox implicadas.
Al estudiar las particularidades de cada una de estas reacciones podemos enmarcarlas, según corresponda, en tres categorías: una se conoce como reacciones redox intramoleculares (en las cuales el agente oxidante y el reductor forman parte del mismo compuesto), otra se identifica como reacciones redox intermoleculares (las más habituales, basadas en sustancias distintas) y la tercera se denomina reacciones redox de desproporción o dismutación (conocidas asimismo como reacciones de autorreducción-oxidación, en las cuales una misma sustancia química actúa, al mismo tiempo, como agente oxidante y agente reductor).
Como se descubre al analizar los datos de este artículo, existe una amplia variedad de reacciones redox (muchas de las cuales resultan imprescindibles para la vida) y un sinfín de aplicaciones prácticas que vale la pena descubrir para aprovechar al máximo este tipo de fenómeno.

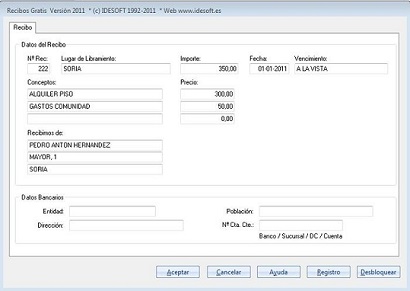
 En la práctica, es posible distinguir entre recibos de
En la práctica, es posible distinguir entre recibos de 
 La realidad virtual tiene un sinfín de aplicaciones. Sirve, por ejemplo, para el ámbito de la
La realidad virtual tiene un sinfín de aplicaciones. Sirve, por ejemplo, para el ámbito de la 
 La razón social de una sociedad de responsabilidad limitada, por ofrecer datos de interés que permitan reconocer múltiples clases de razones sociales, debe acompañarse por la abreviatura ‘Ltda.’ para especificar su naturaleza limitada, mientras que la razón social de una sociedad colectiva tiene que complementar al apellido o nombre completo de algún socio con
La razón social de una sociedad de responsabilidad limitada, por ofrecer datos de interés que permitan reconocer múltiples clases de razones sociales, debe acompañarse por la abreviatura ‘Ltda.’ para especificar su naturaleza limitada, mientras que la razón social de una sociedad colectiva tiene que complementar al apellido o nombre completo de algún socio con 
 Al buscar las aplicaciones de esta palabra uno descubre, por ejemplo, la existencia de una institución de origen colonial conocida como resguardo indígena. En territorio colombiano, por señalar un caso específico, existe el resguardo indígena Cañamomo y Lomaprieta.
Al buscar las aplicaciones de esta palabra uno descubre, por ejemplo, la existencia de una institución de origen colonial conocida como resguardo indígena. En territorio colombiano, por señalar un caso específico, existe el resguardo indígena Cañamomo y Lomaprieta.
 Las referencias bibliográficas, por ejemplo, son fundamentales para identificar a qué obra o publicación corresponden
Las referencias bibliográficas, por ejemplo, son fundamentales para identificar a qué obra o publicación corresponden 
 Al analizar las razones de los desplazamientos masivos podemos distinguir entre refugiados por el cambio climático, refugiados por conflictos bélicos, refugiados por motivos de
Al analizar las razones de los desplazamientos masivos podemos distinguir entre refugiados por el cambio climático, refugiados por conflictos bélicos, refugiados por motivos de 
 En primer lugar, es interesante remarcar que en el mundo se consumen tanto rellenos dulces como salados, así como también hay rellenos que requieren cocción y otros que no. De acuerdo a cada receta y a las preferencias de cada consumidor, se pueden desarrollar rellenos más
En primer lugar, es interesante remarcar que en el mundo se consumen tanto rellenos dulces como salados, así como también hay rellenos que requieren cocción y otros que no. De acuerdo a cada receta y a las preferencias de cada consumidor, se pueden desarrollar rellenos más 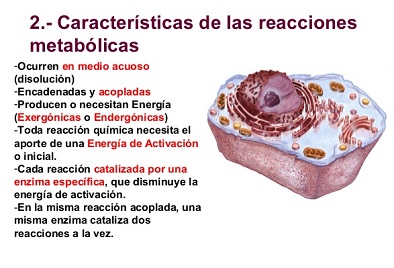
 Al hacer foco en las características de estos fenómenos descubrimos la existencia de reacciones metabólicas anabólicas (basadas en el aprovechamiento de
Al hacer foco en las características de estos fenómenos descubrimos la existencia de reacciones metabólicas anabólicas (basadas en el aprovechamiento de 
 Según se le añada sal o
Según se le añada sal o